RICOMINCIAMO IN SICUREZZA
Il Centro Oculistico Quattroelle è nuovamente operativo nel rispetto di tutte le norme di sicurezza necessarie.
Il Personale Medico e di Assistenza è provvisto di adeguati dispositivi di protezione personale e procede regolarmente con la disinfezione di tutto il materiale diagnostico prima e dopo ogni visita.
Un comportamento corretto e rispettoso dei pazienti e del personale è fondamentale per accedere serenamente ed in sicurezza alle prestazioni.
Retinite pigmentosa
Intervento chirurgico per la retinite pigmentosa
L’estrazione della cataratta (facoemulsificazione con impianto di IOL) ha dei benefici anche negli stadi più evoluti della malattia.
Il rischio di edema maculare cistoide è superiore alla media e va prevenuto ricorrendo a farmaci antiinfiammatori (cortisonici e/o non steroidei) topici, sistemici o intravitreali.
Un po’ di speranza è ragionevolmente riposta nell’ossigenoterapia iperbarica, sedute di camera iperbarica (90 minuti di O2 al giorno, a 2.2 atmosfere assolute, per 5 giorni alla settimana per un mese, una settimana al mese per i successivi 11 mesi, una settimana ogni tre mesi per i successivi due anni) capace secondo talune evidenze di stabilizzare l’evoluzione, in maniera da presentarsi nelle migliori condizioni possibili ai futuribili appuntamenti del prossimo decennio con i trapianti di retina e le retine artificiali. Piccole “pezze” di retina o di epitelio pigmentato sono già state trapiantate in pazienti ciechi non soltanto affetti da RP, con scarsi risultati. Il trapianto nello spazio sottoretinico di cellule retiniche eterologo è comunque una ricerca in corso con importanti potenziali di sviluppo. La problematica tecnica, grazie alla crescente confidenza della chirurgia nel distacco di retina, è di facile soluzione, al contrario dei rischi collegati alla necessità di effettuare terapia immunosoppressiva per via sistemica per lunghi periodi.
Le protesi retiniche (la “retina artificiale”) sono anch’esse in corso di sperimentazione esclusivamente nei pazienti ciechi, con diverse strategie. La più nota segue idealmente il percorso adottato per la sordità, impiantando sulla superficie della retina un microchip fototrasduttore capace di convertire gli stimoli luminosi in impulsi elettrici, trasmessi alle regioni visive del cervello attraverso cellule ganglionari, nervi ottici e vie di conduzione sane. Strade alternative sono rappresentate dall’impianto sotto la retina di micro fotodiodi (Figura 6) o da uno stimolatore elettrico guidato da un sistema di rilevamento montato su occhiale o a livello del cristallino (Figura 7). Report di pazienti che sono passati dal buio completo alla capacità di localizzare sorgenti luminose nello spazio lasciano ben sperare.

Figura 6. Modello in plastica di microchip (occhio bionico) (a) e aspetto in oftalmoscopia di un impianto retinico (b)
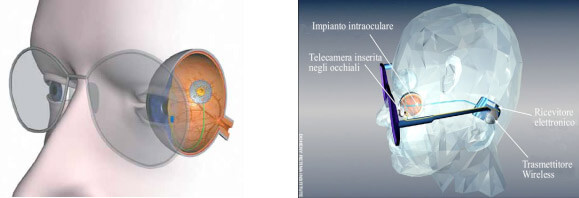
Figura 7. La telecamera degli occhiali rileva le immagini e le trasmette, a mezzo di onde radio, a un dispositivo collocato nella parte anteriore dell’occhio, che invia impulsi elettrici al microprocessore fissato sulla retina, che trasmette a sua volta gli impulsi al nervo ottico. Con questi dati il cervello ricostruisce immagini che, per ora, sono a bassa risoluzione (60 pixel, ovvero una griglia di 6 righe per 10 colonne), quindi una vista di scarsa qualità. la previsione del futuro a breve è comunque di un miglioramento importante della definizione.
Altri trial sperimentali
La terapia genica, ossia l’utilizzo di vettori virali (Lentivirus e Adenovirus) capaci di trasferire il DNA sano per rimpiazzare le proteine difettose, sembra essere la soluzione più vicina, dati i risultati ottenuti in animali con degenerazione ereditaria della retina.
Dopo il trattamento (iniezione sotto la retina dei vettori di geni), oltre il 20% delle cellule del’epitelio pigmentato retinico esprimevano la proteina sana e cani e topi affetti da amaurosi di Leber erano in grado di vedere. A parte le difficoltà nella scelta dei virus più adatti e le tematiche etico-deontologiche legate alla liceità di modificare il patrimonio genetico dell’individuo, questo approccio presenta lo svantaggio di essere applicabile solo nelle forme in cui il gene responsabile è stato isolato e nelle fasi iniziali della malattia, quando la vitalità di un numero consistente di fotorecettori è mantenuta. Fattori di crescita (growth factors, GF), sostanze derivate dal nerve growth factor (NGF) per il quale la Levi Montalcini vinse il premio Nobel, come il CNTF (ciliary neurotrophic factor) e l’X-linked inhibitor of apoptosis hanno mostrato di rallentare la progressione della RP in studi animali. Studi su umani nei cui occhi sono state impiantate cellule di epitelio pigmentato incapsulate di CNTF sono tuttora in corso, con risultati incoraggianti.
Dopo il trattamento (iniezione sotto la retina dei vettori di geni), oltre il 20% delle cellule del’epitelio pigmentato retinico esprimevano la proteina sana e cani e topi affetti da amaurosi di Leber erano in grado di vedere. A parte le difficoltà nella scelta dei virus più adatti e le tematiche etico-deontologiche legate alla liceità di modificare il patrimonio genetico dell’individuo, questo approccio presenta lo svantaggio di essere applicabile solo nelle forme in cui il gene responsabile è stato isolato e nelle fasi iniziali della malattia, quando la vitalità di un numero consistente di fotorecettori è mantenuta. Fattori di crescita (growth factors, GF), sostanze derivate dal nerve growth factor (NGF) per il quale la Levi Montalcini vinse il premio Nobel, come il CNTF (ciliary neurotrophic factor) e l’X-linked inhibitor of apoptosis hanno mostrato di rallentare la progressione della RP in studi animali. Studi su umani nei cui occhi sono state impiantate cellule di epitelio pigmentato incapsulate di CNTF sono tuttora in corso, con risultati incoraggianti.
Cura farmacologica della retinite pigmentosa
La diagnosi di retinite pigmentosa, data la prognosi severa di malattia fortemente invalidante sul piano della formazione scolastica e dell’inserimento nel mondo del lavoro e la carenza di offerte terapeutiche praticabili, può impattare con violenza l’equilibrio emotivo del paziente.
Compito dell’oculista è procurare un sostegno psicologico, anche specializzato, facendo di tutto per massimizzare la visione con gli ausili disponibili e aggiornando l’informazione sui progressi fatti dalle terapie innovative o in fase di sperimentazione.
Ogni due anni sarebbe bene effettuare una perimetria computerizzata e un ERG. Molti trattamenti farmacologici sono stati proposti al fine di ritardare la progressione della malattia:
- Gli antiossidanti e i pigmenti maculari. Non esistono evidenze certe a favore dell’utilità di una supplementazione vitaminica, a parte quella relativa all’uso di dosi elevate di vitamina A palmitato (15.000 U.I. al dì) o beta-carotene 25.000 U.I., che limita la progressione annuale ella retinite pigmentosa del 2%. L’effetto modesto deve esser bilanciato dalla valutazione dei rischi di effetti collaterali non noti nel lungo periodo, con verifiche annuali della funzione del fegato e dei livelli ematici di vitamina A. Gli acidi grassi polinsaturi (omega-3) come l’acido docosaesanoico (DHA) hanno ricevuto conferme contrastanti. La luteina / zeaxantina, pigmenti protettivi dal danno fototossico, devono provenire dalla dieta perché l’organismo non è in grado di sintetizzarli. Il loro utilizzo è stato per ora proposto soltanto nella degenerazione maculare senile. Vitamina C, estratti di mirtillo e prodotti analoghi non servono verosimilmente a nulla.
- L’acetazolamide (Diamox®) viene usato per via sistemica (compresse), non topica, nei casi di edema maculare. I suoi effetti collaterali (astenia, debolezza generale, calcolosi renale, anemia, formicolio a mani e piedi) ne limitano sovente l’uso. Anche l’uso di steroidi (cortisonici) topici con le stesse finalità non dà garanzie di efficacia.
- Taluni farmaci sono da evitare nei pazienti con retinite pigmentosa, come l’isotretinoin (Accutane®), utilizzato per l’acne, riduce l’adattamento al buio, peggiora la visione notturna e riduce la risposta dell’ERG, il famoso citrato di sildenafil (Viagra®), assunto per il trattamento delle disfunzioni erettili, causa alterazioni reversibili dell’ERG, le dosi elevate di vitamina E.
Stile di vita
Una dieta equilibrata e ricca di principi attivi (verdure a foglia verde, frutta, pesce azzurro fresco…) è consigliabile, senza particolari restrizioni.
L’esposizione alla luce solare intensa va evitata e l’utilizzo di speciali lenti filtranti che assorbono l’ultravioletto e la luce blu (Figura 5), riducendone l’effetto tossico sulla retina, va raccomandato negli ambienti aperti. Tali lenti medicali, pur costose, aumentano la sensibilità al contrasto e riducono l’abbagliamento e la fotosensibilità.

Figura 5. Esempio di lenti filtranti antitossiche a nanometri controllati, le fotocromatiche CPF (Corning Photochromic Filters) 550 (a) con trasmissione che passa dal 21% allo stato chiaro al 5% allo stato scuro quando esposti alla luce del sole) e immagini senza (b) e con (c) protezione dall’abbagliamento
Diagnosi della retinite pigmentosa
La perdita progressiva del campo visivo periferico esaminata con la perimetria computerizzata è la procedura classica per porre la diagnosi preliminare e monitorare la condizione.
Zone cieche (scotomi) medio-periferici si uniscono progressivamente formando un anello scotomatoso periferico che si restringe. Quando la visione a tunnel è ridotta a meno di 20°, nonostante un’acuità visiva normale (anche 10/10), i pazienti con retinite pigmentosa possono ottenere i benefici previsti dalla legge per le minorazioni visive. La percezione dei colori è alterata sull’asse blu-giallo, anche se in genere i pazienti non lamentano disturbi della sensibilità cromatica.
I pazienti sono in genere fotofobici per cui si giovano di speciali filtri di protezione; la sensibilità al contrasto e l’adattamento al buio sono assai ridotte. Il test moderno per eccellenza è l’Elettroretinogramma (ERG), che fornisce una misura obiettiva e assai sensibile del deficit dei fotorecettori e dell’epitelio pigmentato (Figura 4).
Le alterazioni tipiche (riduzione dei segnali a carico dei coni e dei bastoncelli, onda a e b) sono evidenziabili già nella prima infanzia, con due modalità prevalenti: la forma bastoncelli-coni (Rod-Cone, R-C) in cui è maggiormente alterata la risposta dei bastoncelli e clinicamente prevalgono i disturbi della visione notturna e periferica con buona conservazione della visione centrale, e la forma coni-bastoncelli (Cone-Rod, C-R) che caratterizza invece il quadro opposto.
I potenziali evocati visivi (PEV) e l’elettrooculogramma (EOG), invece, non aggiungono dati interessanti. L’EOG alterato, con ERG normale consente la diagnosi differenziale con la maculopatia vitelliforme di Best.

Figura 4. Tracciati ERG normale (a sinistra) e alterati in RP con distrofia R-C e C-R
OCT, fluorangiografia e microperimetria sono utili per documentare la presenza eventuale di edema maculare cistoide, e quindi d’individuare le possibilità di recupero funzionale in seguito alle terapie del caso.
La tipizzazione genetica (con prelievo di sangue per la ricerca di mutazioni a carico del DNA), oltre a determinare il rischio a carico della prole e consigliare in merito, sarà verosimilmente sempre più utile man mano che verranno disponibili le terapie a livello genico.
L’obiettivo è quello di effettuare uno scrupoloso bio-banking del DNA dei pazienti, per farsi trovar pronti all’appuntamento con le nuove frontiere (sistemi nanotecnologici intravitreali per il rilascio continuativo di farmaci neurotrofici, cellule staminali o terapie geniche trasfettanti) che avranno bisogno di ricerche territoriali mirate all’interno di ciascuna etnia.
Cos’è la retinite pigmentosa
Con il termine retinite pigmentosa (RP) si intende un gruppo di malattie che condividono un difetto geneticamente determinato, e quindi ereditario, della funzione dei fotorecettori e dell’epitelio pigmentato retinico (eredo-degenerazioni tapeto-retiniche).
L’affezione, degenerativa e non infiammatoria (nonostante la classica definizione di retinite), è caratterizzata dalla perdita progressiva della visione periferica (visione tubolare o “a cannocchiale”) e dalle difficoltà in visione notturna che possono arrivare a interessare la visione centrale, con gradi anche gravi di perdita del visus (sopra i 50 anni oltre il 50% delle RP vede meno di 5/10, 5 casi su mille vedono 1/20) e dall’aspetto tipicamente pigmentato della media periferia retinica (Figura 1 a, b).
Cause della retinite pigmentosa
Per quanto i portatori dei geni difettosi (ne sono stati individuati centinaia) siano assai frequenti (1 su 100), la prevalenza della malattia è di un caso su 4.000; la definizione di “malattia rara”, prevista dalla legge per la relativa esenzione dal pagamento del ticket per le prestazioni oculistiche, è quindi discutibile.
Non c’è predilezione di sesso, anche se la forma legata al cromosoma X si esprime soltanto nei maschi. L’età di esordio è variabile, ma in genere la prima diagnosi viene posta nei giovani adulti. Entrambi gli occhi sono colpiti, il più delle volte in modo asimmetrico.
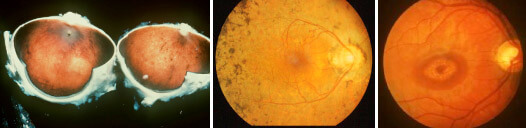
Figura 1. Aspetto autoptico macroscopico (occhio di cadavere, sezionato in due, a) e clinico (fundus) di un occhio affetto da retinite pigmentosa (b). In c) l’oftalmoscopia mostra il quadro tipico dell’atrofia della macula affetta da distrofia dei coni
I geni incriminati nella fisiopatologia della retinite pigmentosa sono assai eterogenei. Si trasmettono con modalità autosomica dominante (come la mutazione a carico di un aminoacido della rodopsina, la proteina dei fotorecettori retinici responsabile della trasformazione della luce nell’impulso nervoso) nel 25% dei casi, recessiva nel 15-20%, recessiva legata al sesso (X-linked) nel 5-10%, mentre nella restante metà dei casi nessuna parentela è individuabile.
Il difetto genetico provoca la morte cellulare programmata (apoptosi), ovviamente indesiderata, dei fotorecettori (in genere i bastoncelli ma talora anche i coni con l’epitelio pigmentato) (Figura 1c e 1d).
Si osserva in genere l’accorciamento del segmento esterno (il “bastoncello”) dei fotorecettori, che poi si amputa, in particolare nelle regioni medio-periferiche e inferiori della retina, deputate alla visione periferica e notturna. I nuclei cellulari si riducono di densità e alla fine i fotorecettori scompaiono.
I sintomi della retinite pigmentosa
In anamnesi, cercando nel pedigree, si trovano sovente precedenti di retinite pigmentosa nei famigliari di 1° e 2° grado.
I classici sintomi della retinite pigmentosa sono:
- La riduzione della capacità visiva in condizioni di penombra (emeralopia o nictalopia), variabile da qualche lentezza nell’adattamento dalla luce al buio, alle difficoltà a muoversi in locali a luce soffusa e alla guida con la nebbia al crepuscolo sino ad una vera cecità notturna, è considerato il “marchio di fabbrica”. Nella forma tipica compare in genere tra i 15 e i 30 anni.
- Il calo visivo è lento e progressivo (ogni anno viene perso il 4-5% del campo visivo), spesso asintomatico. I famigliari notano tuttavia che il paziente inciampa spesso, boccia la macchina, non riesce in sport come il tennis e la pallacanestro dove è importante la visione periferica; raramente, il paziente riferisce una “visione a tunnel”. Nelle forme con interessamento dei coni è compromessa anche la visione centrale.
- Le fotopsie, ovvero la percezione di bagliori, flash simili a quelli dell’emicrania oftalmica, ma che a differenza di quest’ultima, possono essere continui e non episodici e la fotofobia (marcata sensazione d’abbagliamento).
- I segni dell’esame obiettivo oculare sono assai variabili. L’acuità visiva varia dai 10/10 alla percezione della luce, ma di solito si mantiene più che discreta anche negli stadi più evoluti, nonostante le restrizioni di vita legate al ridotto campo visivo siano quelle dell’handicap visivo. Cornea e pupilla appaiono normali. In un caso su 2, intorno ai 40-50 anni, il cristallino si opacizza parzialmente (cataratta sottocapsulare posteriore) (Figura 2a). Le lesioni tipiche (pigmentazioni “a spicole ossee”) (Figura 1a e 1b) possono essere assenti nelle fasi precoci, così come il restringimento del calibro dell’albero arterioso, il pallore cereo del disco ottico e l’atrofia della retina medio-periferica. Una cellularità vitreale è frequente così come una sindrome dell’interfaccia e un edema maculare. La forma tipica rappresenta l’85% dei casi. Le varianti più frequenti sono la retinite punctata albescente, con depositi giallastri periferici, la coroideremia e l’atrofia girata della coroide, con zone più o meno ampie e festonate di atrofia retinica e la distrofia dei coni associata o meno a quella dei bastoncelli, con alterazioni pigmentarie della macula.
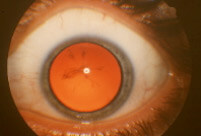
Figura 2. Opacità tipiche del cristallino in RP
La valutazione sistemica è importante per individuare le associazioni con:
- perdita dell’udito (sindrome di Usher), spesso congenita e variabile da gradi lievi alla sordità completa, presente nel 10% circa dei casi di RP. Altre sindromi come quella di Waardenburg, di Alport e la malattia di Refsum, presentano ipoacusia e diverse manifestazioni sistemiche combinate a RP;
- ptosi palpebrale, paralisi dei muscoli oculomotori e blocco di conduzione cardiaco, che può avere conseguenze anche letali (sindrome di Kearns-Sayre, difetto genetico molecolare a livello dei mitocondri);
- malassorbimento intestinale dei grassi e degenerazioni neurologiche spino-cerebellari (abetalipoproteinemia, deficit di produzione dell’apolipoproteina B);
- mucopolisaccaridosi (sindrome di Hurler, di Scheie, di Sanfilippo);
- lipofuscinosi ceroidi neuronali, caratterizzate da demenza ed epilessia (forme infantili, malattia di Jansky-Bielschowsky, giovanili, malattia di Vogt-Spielmeier-Batten e dell’adulto, sindrome di Kufs);
- polidattilia (Figura 3), disfunzioni renali anche gravi, statura bassa, intelligenza subnormale, obesità, ipogonadismo (sindrome di Lawrence-Moon-Bardet-Biedl).
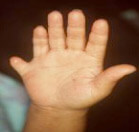
Figura 3. Dito soprannumerario (polidattilia) in RP

