RICOMINCIAMO IN SICUREZZA
Il Centro Oculistico Quattroelle è nuovamente operativo nel rispetto di tutte le norme di sicurezza necessarie.
Il Personale Medico e di Assistenza è provvisto di adeguati dispositivi di protezione personale e procede regolarmente con la disinfezione di tutto il materiale diagnostico prima e dopo ogni visita.
Un comportamento corretto e rispettoso dei pazienti e del personale è fondamentale per accedere serenamente ed in sicurezza alle prestazioni.
Distrofie stromali
Cosa sono le Distrofie stromali? Quanti tipi ne esistono?
La Distrofia reticolare
Tra le distrofie stromali, la reticolare (amiloidosi corneale, tipo lattice, LCD) è una delle più comuni. A trasmissione autosomica dominante, l’anomalia consiste nella deposizione di amiloide nello stroma corneale e negli spazi subepiteliali, configurando il quadro di piccoli accumuli sferoidali, macchioline biancastre unite dal caratteristico reticolato di linee, a carico dello stroma anteriore (Figura 5), bene evidenziabili in retroilluminazione.
Clinicamente, si distingue un tipo I (Biber- Haab-Dimmer), un tipo II (con amiloidosi sistemica, sindrome di Meretoja) e i tipi III e IIIA. I difetti del tipo I e del tipo III e IIIA, come molte altre distrofie corneali (granulare, Avellino, Reis-Bückler) sono stati mappati sul gene TGFBI (BIGH3) del cromosoma 5q31 (il tipo III viene però trasmesso con modalità autosomica recessiva), mentre il tipo II è stato mappato sul gene 9q34.
La forma di Biber-Haab-Dimmer si mostra verso la fine della prima decade di vita con erosioni ricorrenti che precedono i cambiamenti tipici dello stroma. La progressiva coalescenza delle ramificazioni, tipo tela di ragno e la diffusione posteriore delle opacità (che però non raggiunge mai la Descemet), conduce ad un deficit funzionale importante, tale da richiedere una cheratoplastica prima dei 50 anni.
La sindrome di Meretoja, sistemica, si presenta intorno ai 30-40 anni con paralisi facciale progressiva. Rispetto al tipo I, le erosioni ricorrenti meno frequenti, le linee reticolate sono più fini, corte, disseminate in maniera casuale, rade e delicate, con un orientamento più radiale. La cheratoplastica viene in genere effettuata più tardivamente (60-70 anni). Le manifestazioni sistemiche comprendono la neuropatia bilaterale progressiva cronica e periferica, disartria, cute secca, molle e pruriginosa, un’espressione caratteristica del volto “a maschera”, labbra protrudenti e orecchie pendule. L’amiloidosi può anche coinvolgere reni e cuore, mettendo a rischio le funzioni vitali.
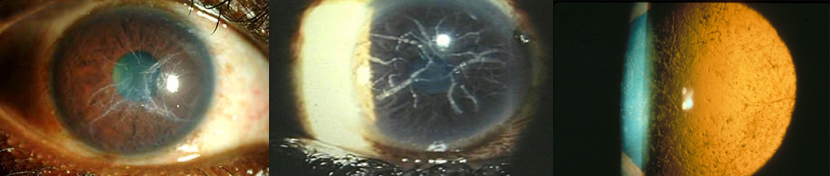
Figura 5. Aspetto reticolato tipico della distrofia a lattice a luce diffusa (a, b) e in retroilluminazione (c)
Distrofia cristallina di Schneider
La distrofia centrale (cristallina) di Schneider (SCCD) interessa la membrana di Bowman e gli strati più superficiali dello stroma. L’anomalia sta in UBIAD1, gene coinvolto nel metabolismo del colesterolo, mappato sul cromosoma 1p36-p34.1, e viene ereditata con modalità autosomica dominante.
Un eccessivo accumulo di colesterolo e lipidi è verosimilmente alla base dell’opacizzazione bilaterale, che esordisce alla nascita o nella prima infanzia con deficit visivo, che progredisce tipicamente, insieme ad una riduzione della sensibilità corneale e raramente diventa grave (in genere intorno ai 6-8/10 prima dei 40 anni e 5-6/10 dopo i 40 anni, con discreto mantenimento della visione notturna), e abbagliamento.
Le caratteristiche opacità aghiformi scintillanti (cristalli), subepiteliali, rotondeggianti, si rinvengono nelle regioni centrali e paracentrali di cornee diffusamente opache (Figura 6).
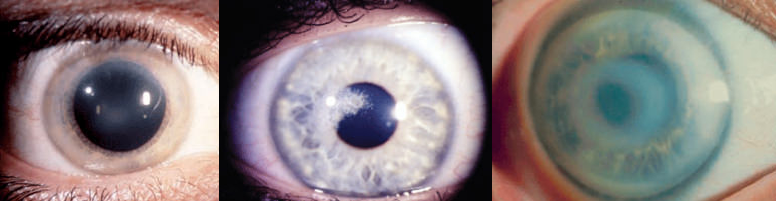
Figura 6. La storia naturale della distrofia di Schneider: iniziali opacità centrali a mosaico con pochi cristalli, visus poco compromesso, sensibilità corneale mantenuta (paziente sotto ai 20 anni) (a); cristalli di colesterolo più evidenti, con un iniziale arco lipoide, all’età di 40 anni (b): l’acuità visiva e la sensibilità cheratica cominciano a ridursi; in un paziente più anziano (75 anni) luna velatura diffusa riempie le regioni medio-periferiche tra l’opacità centrale e un denso arco lipoideo periferico (c)
Esistono due entità cliniche distinte di distrofia granulare, il tipo I (classico, di Groenouw o GCDI) e il tipo II (detto di Avellino, GCDII).
La distrofia granulare di tipo I è caratterizzata dalla presenza bilaterale di piccoli “granuli” o “briciole”, molteplici opacità biancastre, irregolari ma ben delimitate da zone circostanti trasparenti, a livello dello stroma corneale superficiale centrale, con la periferia indenne. Le lesioni esordiscono in genere prima dei vent’anni, senza preferenze di sesso, con abbagliamento e fotofobia. Tendono nel tempo a progredire (aumentano di dimensioni e numero) e a confluire gradualmente, mentre gli spazi circostanti perdono trasparenza diventando foschi, esitando quindi in un deficit visivo ingravescente, anche intenso, tra i 25 e i 45 anni. Si possono riscontrare erosioni epiteliali dolorose con opacizzazioni secondarie e neovascolarizzazioni.
Rispetto al tipo I, la distrofia granulare di tipo II tende a mostrare un minor numero di depositi, con un aspetto “misto” (simili a fiocchi di neve), anche a livello istopatologico, tra il granulare e la reticolare, queste ultime localizzate nello stroma intermedio e posteriore. La prima è più frequente in Europa, la GCDII prevale in Giappone, Corea e Stati Uniti. Si tratta di condizioni autosomiche dominanti (gli omozigoti sviluppano quadri clinici più precoci e severi), causate da mutazioni del gene multifunzionale TGFBI, mappate a carico del cromosoma 5 (5q31) che codifica per una proteina detta cheratoepitelina. La GCDI è dovuta alla mutazione p. Arg555Trp, la GCDII alla mutazione p. Arg124His.
Recentemente, ha fatto scalpore il risarcimento ottenuto da un paziente statunitense sottopostosi ad un trattamento con laser ad eccimeri a scopo rifrattivo (LASIK) che ha scatenato una distrofia di Avellino, evidentemente latente e non riconosciuta, provocando un danno grave alla visione. La vasta eco mondiale del caso ha sensibilizzato la comunità oculistica sull’opportunità di sicurezza test preliminari sul DNA, e una multinazionale ha cavalcato il momento per farne un vero e proprio business.
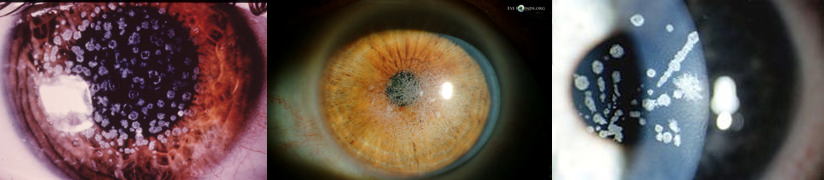
Figura 7. Quadri clinici biomicroscopici di distrofia granulare di tipo I (classica) (a) e tipo II (di Avellino) (b)

